“CALOR Y TEMPERATURA”
El calor es la energía que tiene un objeto
debida al movimiento de sus átomos y moléculas que están constantemente
vibrando, moviéndose y chocando unas con otras. Cuando añadimos energía a un
objeto, sus átomos y moléculas se mueven más deprisa, incrementando su energía
de movimiento o calor. Incluso los objetos más fríos poseen algo de calor
porque sus átomos se están moviendo.
Generalmente, el calor es una forma de energía
asociada al movimiento de los átomos, moléculas y otras partículas que forman
la materia. El calor puede ser creado por reacciones químicas (como en la
combustión), nucleares (como en la fusión en el interior del Sol), disipación
electromagnética (como en los hornos de microondas) o por disipación mecánica
(fricción). Su concepto está ligado al Principio Cero de la Termodinámica,
según el que dos cuerpos en contacto
La cantidad de energía térmica intercambiada
se mide en calorías, que es la cantidad de energía que hay que suministrar a un
gramo de agua para elevar su temperatura un grado centígrado. El múltiplo más
utilizado es la kilo-caloría (kcal):
1 kcal = 1000 cal
De aquí se desprende el concepto de calor específico de una sustancia,
que se define como la energía necesaria para elevar la temperatura de un mol de
dicha sustancia un grado centígrado.
Joule estableció el equivalente mecánico del calor:
1 cal = 4 186 joule
La temperatura:
La temperatura es una magnitud referida a las nociones comunes de calor
medible mediante un termómetro.
La temperatura es una medida del calor o energía térmica de las
partículas en una sustancia. Como lo que medimos en sus movimiento medio, la
temperatura no depende del número de partículas en un objeto y por lo tanto no
depende de su tamaño. Por ejemplo, la temperatura de un cazo de agua hirviendo
es la misma que la temperatura de una olla de agua hirviendo, a pesar de que la
olla sea mucho más grande y tenga millones y millones de moléculas de agua más
que el cazo.
Nosotros experimentamos la temperatura todos los días. Cuando hace calor
o cuando tenemos fiebre sentimos calor y cuando está nevando sentimos frío.
Cuando estamos hirviendo agua, hacemos que la temperatura aumente y cuando
estamos haciendo polos o paletas de helado esperamos que la temperatura baje.
En el Sistema Internacional de Unidades, la unidad de temperatura es el
kelvin. Sin embargo, está muy generalizado el uso de otras escalas de
temperatura, concretamente la escala Celsius (o centígrada), y, en los países
anglosajones, la escala Fahrenheit. Una diferencia de temperatura de un kelvin
equivale a una diferencia de un grado centígrado.
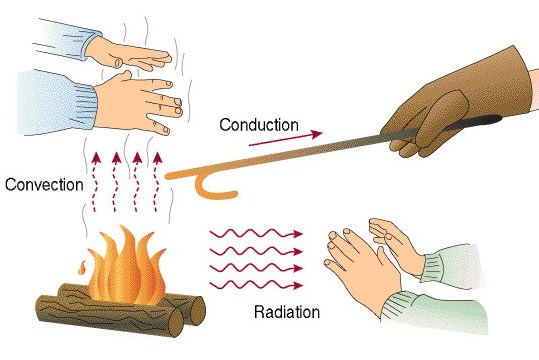
Clases de propagación de calor:
Conducción: Es la transmisión del calor por contacto
molecular. La propagación tiene lugar cuando se ponen en contacto dos cuerpos
que están a diferentes temperaturas o dos puntos de un mismo objeto a distintas
temperaturas. Las moléculas que reciben directamente el calor aumentan su
vibración y chocan con las que rodean; estas a su vez hacen lo mismo con sus
vecinas hasta que todas las moléculas del cuerpo se agitan.
Convección: El calor se transporta con la masa misma. Es
la forma en que se transmite el calor en los fluidos, es decir, en los líquidos
y en los gases. Como el calor hace disminuir la densidad, las masas de aire o
agua calientes ascienden y las frías descienden.
Radiación: La transferencia de calor por radiación se
hace por medio de ondas electromagnéticas que pueden propagarse igual en un
medio material que en la ausencia de este. Los cuerpos oscuros absorben la
mayor parte de la radiación que reciben, en cambio los más claros reflejan más
radiación de la que absorben.
los tres tipos de propagación en un ejemplo:
Efectos del calor:
–El calor dilata los cuerpos: todos los cuerpos, cuando se calientan,
aumentan de volumen.
conducción del
calor en los sólidos:
conductores: tienen sus átomos
ordenados y de forma muy compacta.
aislantes: no tienen sus
átomos ordenados ni dispuestos de forma compacta.
los estados de la
materia:
Solido: están formados por partículas juntas, ordenadas y fuertemente unidas
unas a otras. Por eso tienen forma constante.
Los líquidos:
están formados por partículas juntas pero no unidas unas a otras. Por eso tiene forma variable.
Los gases: están formadas por partículas separadas. Si los presionamos disminuyen su
volumen pues sus partículas se juntan.
cambios de
estado:
Cuando un cuerpo,
por acción del calor o del frío pasa de un estado a otro, decimos que ha
cambiado de estado. En el caso del agua: cuando hace calor, el hielo se derrite
y si calentamos agua líquida vemos que se evapora. El resto de las sustancias
también puede cambiar de estado si se modifican las condiciones en que se
encuentran. Además de la temperatura, también la presión influye en el estado
en que se encuentran las sustancias.











No hay comentarios.:
Publicar un comentario